#IntesaScienceNews: Risultati positivi per l’anti Hiv Fostemsavir. L’Italia primato nella commercializzazione mondiale dell’antivirale.
Glasgow: la ViiV healthcare annuncia buoni traguardi raggiunti dallo studio di fase III BRIGHTE dell’anti HIV Fostemsavir. L’Italia, primato nella commercializzazione mondiale dell’antivirale.
Alla fine del mese di ottobre si è tenuto a Glasgow un congresso sull’HIV, in cui ha partecipato l’azienda ViiV health care -un’azienda farmaceutica mondiale specializzata nel settore HIV- la quale ha annunciato i risultati positivi dello studio di fase III BRIGHTE.
L’HIV è il virus dell’immunodeficienza umana, l’agente responsabile della AIDS (Acquired immune deficiency sindrome), cioè della “Sindrome da immunodeficienza acquisita”. Nelle persone malate di Aids le difese immunitarie normalmente presenti nell’organismo sono state fortemente indebolite a causa di un virus denominato Hiv (Human immunodeficiency virus) […] (OMS).
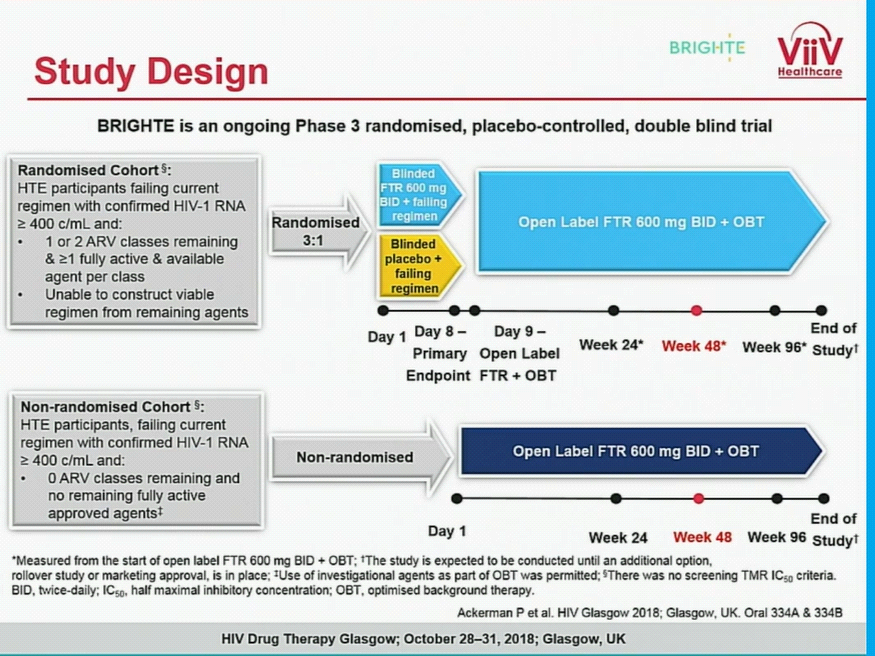
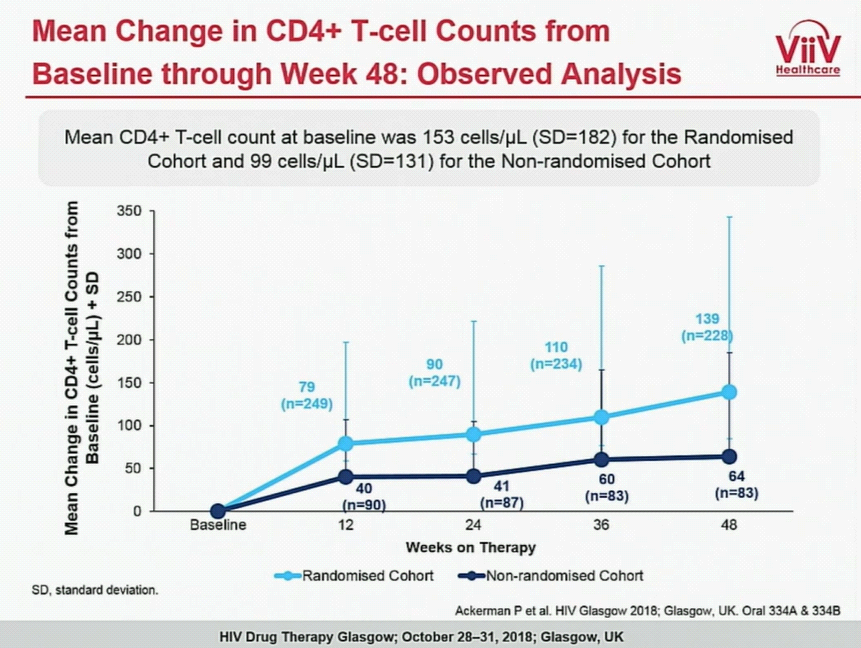
Lo studio BRIGHTE riguarda la sperimentazione clinica di fase III del profarmaco fostemsavir in pazienti affetti da HIV-1 multitrattati (heavily treatment-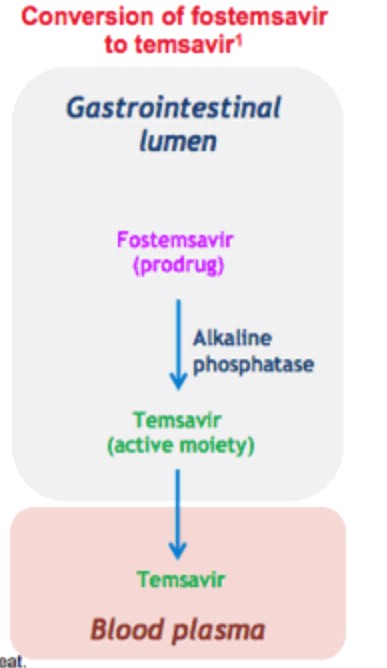 experienced); in particolare i risultati positivi sono giunti dalle analisi su un sottogruppo di una coorte randomizzata sottoposto al trattamento con fostemsavir in combinazione con il trattamento di base ottimizzato (optimised background treatment-OBT): il 54% dei pazienti nella coorte randomizzata ha mantenuto la soppressione virologica (<40 copie/mL) dopo 48 settimane di trattamento con fostemsavir associato alla terapia di base ottimizzata. Inoltre i pazienti nella coorte randomizzata hanno mostrato un miglioramento immunologico a 48 settimane come dimostrato dall’incremento della conta delle cellule T CD4+ (miglioramento medio dall’inizio dello studio di +139 cellule/µL). Questi dati a 48 settimane incrementano i dati di endpoint primario (giorno 8) annunciati lo scorso anno http://www.natap.org/2017/EACS/EACS_34.htm.
experienced); in particolare i risultati positivi sono giunti dalle analisi su un sottogruppo di una coorte randomizzata sottoposto al trattamento con fostemsavir in combinazione con il trattamento di base ottimizzato (optimised background treatment-OBT): il 54% dei pazienti nella coorte randomizzata ha mantenuto la soppressione virologica (<40 copie/mL) dopo 48 settimane di trattamento con fostemsavir associato alla terapia di base ottimizzata. Inoltre i pazienti nella coorte randomizzata hanno mostrato un miglioramento immunologico a 48 settimane come dimostrato dall’incremento della conta delle cellule T CD4+ (miglioramento medio dall’inizio dello studio di +139 cellule/µL). Questi dati a 48 settimane incrementano i dati di endpoint primario (giorno 8) annunciati lo scorso anno http://www.natap.org/2017/EACS/EACS_34.htm.
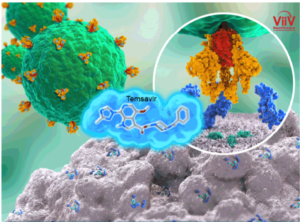
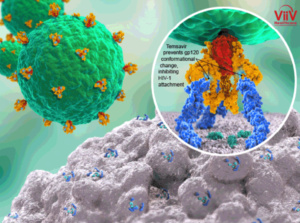
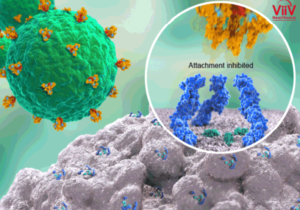
Fostemsavir è un profarmaco che viene bioattivato dalle fosfatasi alcaline, le quali inducono alla trasformazione in molecola attiva, Temsavir: è proprio questo l’inibitore di quell’attacco da parte della glicoproteina 120 (gp120) presente sul mantello del retrovirus dell’HIV al nostro sistema immunitario. In particolare, il meccanismo attraverso cui Temsavir previene l’attacco del virus e quindi la sua entrata nella cellula ospite CD4+ T implica la formazione di un legame con la gp120 in un sito in prossimità dei siti di legame del CD4: si ha variazione conformazionale della gp120 tale da impedire l’interazione con il recettore CD4+ sui Linfociti T. Il risultato è un accumulo del retrovirus al livello extracellulare accompagnato da un aumento del numero di linfociti T CD4 che lo debellano.
Il ricercatore clinico della ViiVHealthcare Peter Ackerman (https://vimeo.com/298577848) ha mostrato durante la conferenza a Glasgow i risultati positivi raggiunti alla 48esima settimana dalla sperimentazione, ancora in corso, BRIGHTE:

Ai risultati ottenuti dalla sperimentazione nel primo endopint (giorno 8) e nel secondo (24 settimane) si sono sommati i seguenti dati positivi: nello studio BRIGHTE i sottogruppi di pazienti con elevati valori di HIV-1 RNA (>=100,000 c/mL) e conta di CD4+ molto bassa (<20 cellule-/mm3) hanno avuto i tassi di risposta virologica meno elevati alla 48esima settimana. Sono stati osservati tassi comparabili di aumento del numero di cellule CD4+ T nei sottogruppi per età, genere, razza e regione geografica. E’ da rilevare che i soggetti con più bassa conta di CD4 (<20 cellule/μL), hanno avuto un miglioramento paragonabile della variazione media nel conteggio del CD4 basale rispetto a quelli con i valori più alti di CD4 basale (>200 cellule/μL); +145 e +150 cellule/μL, rispettivamente.
Tuttavia, alcuni pazienti che sono stati sottoposti alla speriementazione clinica hanno mostrato segni di reazioni avverse al trattamento con il farmaco:
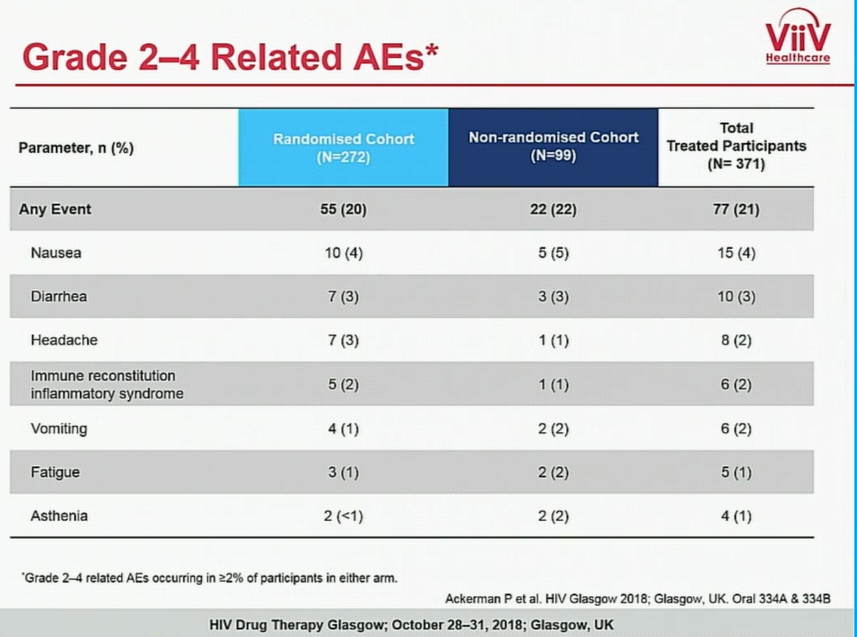
I più comuni correlati a Fostemsavir sono stati diarrea, nausea e cefalea. Il 35 per cento dei partecipanti ha avuto uno o più eventi avversi seri (SAE) correlati soprattutto ad infezioni, comparse nella maggior parte dei pazienti immunocompromessi. Il tre per cento (3%) degli eventi avversi seri (SAE) sono apparsi correlati al trattamento in studio e il sette per cento (7%) dei partecipanti è uscito dallo studio per un evento avverso.
I dati raccolti, dunque, alla settimana 48 dall’inizio della sperimentazione clinica di fase III di Fostemsavir risultano ancora positivi e incrementano così la fiducia nella sperimentazione di nuove terapie che prevengono la replicazione del virus HIV, in particolare per le persone che sviluppano resistenze ai loro regimi di trattamento.
Inoltre, i risultati hanno mostrato che non si è riscontrata alcuna resistenza crociata con le altre classi antiretrovirali (ARV), utile per quei pazienti che sono diventati resistenti alla maggior parte degli altri farmaci.
John C. Pottage, Chief Scientific and Medical Officer of ViiV Healthcare, afferma: “Siamo particolarmente lieti per i risultati dello studio BRIGHTE che ha valutato fostemsavir, primo farmaco della classe degli inibitori dell’attachment, sviluppato specificamente per i pazienti multitrattati (HTE heavily treatment-experienced). Le persone che vivono con HIV che hanno partecipato allo studio avevano avuto il fallimento dei loro trattamenti antiretrovirali e avevano poche opzioni terapeutiche rimaste disponibili; siamo incoraggiati nel vedere che il trattamento con fostemsavir porta sia a significative riduzioni nella carica virale sia a miglioramenti nella salute del sistema immunitario dei pazienti. Come ViiV Healthcare rimaniamo impegnati nello sviluppo di farmaci innovativi per tutte le persone che vivono con HIV e ci aspettiamo di ottenere le approvazioni regolatorie per fostemsavir nel 2019.”
Il trattamento farmacologico con Fostemsavir nella prevenzione della replicazione del virus dell’HIV sarà presto possibile al termine dello studio BRIGHTE. L’azienda farmaceutica GSK avrà un ruolo predominante nel mercato globale di questo farmaco: ha gia creato un’ampia area nel sito produttivo di San Polo di Torrile (Parma) dedicata alla produzione e alla commercializzazione globale di Fostemsavir.
Ancora una volta questi studi sottolineano il trionfo della terapia farmacologia nella prevenzione dello sviluppo di certe malattie virali che porterebbero nella maggior parte dei casi la morte dei soggetti che ne sono affetti.
Tuttavia, l’azienda ViiV Healthcare ricorda che è fondamentale ricorrere alla prevenzione del contagio del virus grazie ad una campagna di sensibilizzazione rivolta a tutta la popolazione mondiale. E’ inoltre importante riconoscere se il contaggio è già avvenuto, ricorrendo ad opportuni metodi proposti, al fine di tutelare e salvaguardare la salute degli individui con cui si sta a contatto.
Informazioni su ViiV Healthcare
ViiV Healthcare è un’azienda farmaceutica mondiale specializzata nel settore HIV. Nasce nel novembre 2009 da GlaxoSmithKline (LSE: GSK) e Pfizer (NYSE: PFE) cui si è aggiunta nell’ottobre 2012 Shionogi ed è totalmente dedicata allo sviluppo di trattamenti innovativi e all’assistenza delle persone che vivono con HIV e di quelle a rischio di contrarre l’HIV. ViiV ambisce ad occuparsi di HIV e AIDS in modo più ampio e approfondito di quanto sia mai stato fatto prima e a portare avanti un approccio nuovo sia nello sviluppo di farmaci efficaci e innovativi per il trattamento e la prevenzione dell’HIV, sia nel supporto alle persone che vivono con infezione da HIV.
Informazioni su GSK
GSK – una delle principali aziende farmaceutiche e sanitarie a livello mondiale basata sulla ricerca – è impegnata a migliorare la qualità della vita umana consentendo alle persone di essere più sane, più attive e più longeve.
http://www.natap.org/2017/EACS/EACS_34.htm
Articolo a cura di: Aurora Battaglia